


自闭症谱系障碍(Autism spectrum disorder, ASD)是指一组复杂的神经发育障碍,其特征是在社会交流和社会互动方面持续存在困难,限制和重复的行为(包括感官行为),活动或兴趣,而早期症状严重影响了患者适应社会的能力。作为遗传性最强的精神疾病之一,虽然ASD的诊断标准明确,但其严重程度和表现症状因人而异。在中国自闭症患者中,青少年患者的比例高达20%,并以每年20万患者的速度增加。但由于ASD发病机制的复杂性和异质性,加上缺乏一个合适的人类细胞模型系统,使得探讨ASD在人类发育中的病理生理机制变得困难,临床上也尚无有效的治疗手段。

近日,发表在《Molecular Psychiatry》IF=15.992的文章 “Dysfunction of NMDA receptors in neuronal models of an autism spectrum disorder patient with a DSCAM mutation and in Dscam-knockout mice”,来自韩国的科学家利用诱导多能干细胞(hiPSC)技术和动物模型,分别从细胞和个体水平揭示了由DSCAM基因突变造成的疾病发生机制。
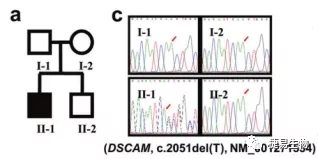

在许多ASD患者中都存在细胞粘附分子DSCAM基因变异,DSCAM基因在胎儿发育期间高度表达,特别是在大脑区域,如海马、小脑、大脑皮层和侧脑中。在以往的研究中,已经证实DSCAM表达水平的改变可能会导致突触传递障碍,DSCAM突变小鼠(DSCAMdel17)表现出严重运动功能下降,运动学习障碍。然而DSCAM敲除小鼠是否会出现社交障碍的表现,以及在DSCAM突变的hiPSC-神经元模型上细胞表型的差异是研究人员重点关注的。
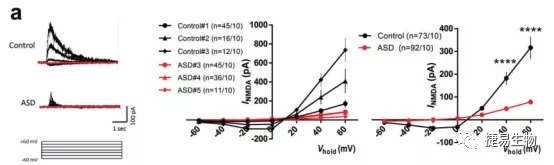
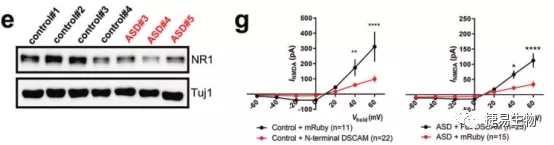
通过建立自闭症谱系障碍患儿(DSCAM c.2051del)的诱导多能干细胞,并将其诱导分化为端脑神经元细胞(iN),研究人员发现,与对照iN细胞相比ASD细胞轴突长度明显缩短。mRNA高通量测序结果显示,ASD来源的神经元的突触信号传导、神经元发育的信号通路存在明显差异,同时与神经突触功能相关基因,如NR1、NR2B、LRRTM1和SYT6表达量显著降低,NR1和 NR2B作为N-甲基-D-天门冬氨酸受体(NMDAR)的亚单位直接影响了患者神经元中NMDAR通道功能,造成电流强度 (I NMDA)降低。通过在ASD患者和正常对照组神经元中分别导入DSCAM正常型和突变型载体,研究人员发现由突变型载体翻译的截短蛋白会造成正常神经元中INMDA的降低;而ASD患者的神经元中通过表达正常DSCAM蛋白,I NMDA有了显著提升,接近正常对照。
进一步的机制研究,发现DSCAM突变可能通过影响NR1的正常表达,进而造成对NMDAR通道电流的影响,而细胞外信号调节激酶(ERK)的活性是由NMDAR激活调节的,并与NMDAR电流同步。在ASD患者的神经元中,我们发现ERK蛋白的磷酸化水平(pERK)、pERK/Ngn2明显降低,这些结果都说明DSCAM通过N-甲基-D-天门冬氨酸受体(NMDAR),进而调控了细胞内ERK信号通路,而在ASD患者的神经元中,这种调控作用明显降低。
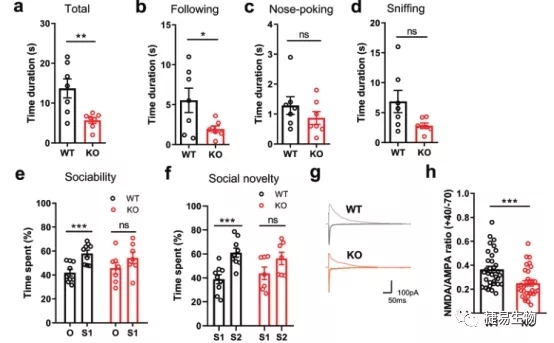
通过比较DSCAM杂合敲除小鼠和正常小鼠的行为,研究人员发现,DSCAM +/ -小鼠之间互动时间和跟随时间降低,与陌生小鼠的互动“兴趣”和时间也明显降低,这表明敲除小鼠的社交能力受到了影响。通过对小鼠脑片中皮层神经元进行电生理检测,敲除小鼠中NMDA/AMPA电流比值明显降低,说明NMDAR功能减退是DSCAM +/−小鼠出现自闭症行为的基础。
>>>>
小结
诱导多能干细胞(iPSC)技术为自闭症谱系障碍疾病提供了新的技术平台,通过获得患者特异的诱导多能干细胞将有望助力药物研发和个性化的治疗。