


临床上测序检出候选位点,怀疑变异位点影响pre-mRNA的剪切,但却没有样本来进行验证怎么办?Minigene技术无疑是优选,但若Minigene技术解决不了怎么办?
2022年12月发表的这篇文章可以给我们提供些思路。

1研究背景
Brugada综合征与先天性长QT综合征是罕见的常染色体显性孟德尔遗传病,主要涉及心脏离子通道蛋白的突变。约20%的BrS患者中检出SCN5A基因变异,约80%的先天性长QT综合征患者在KCNQ1基因、KCNH2基因和SCN5A基因上检出变异。测序技术的发展给这些基因突变的杂合子以及先证者的家族成员提供了发现风险的机会。
在常规的数据分析流程中,外显子两侧翼±1bp及±2bp的经典剪接变异因可能满足PVS1证据的条件常被归为P/LP变异。然而,在这2bp外的罕见的剪接变异位点则很难被解读,大多被归为VUS变异。
本文通过Minigene实验和基于iPSC-CM细胞的RT-PCR,在RNA水平验证从遗传性心律失常患者中检出的预测可能影响剪接的变异,实现了变异的重新定级和分子诊断。
2研究思路

3实验步骤及结果
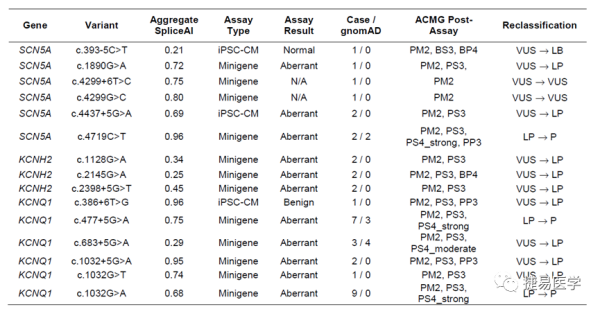
1)变异的选择:前期BrS与LQTS患者检出的预测可能影响剪接而非影响蛋白编码序列的变异,此外,需满足gnomAD数据库中等位频率<2.5e-5,此阈值是基于最大等位基因频率的理论预测和经验测量获得,最终对15个变异进一步进行研究。
2)Minigene实验:根据图2A的流程构建载体,经过最后通过RT-PCR、电泳及Sanger测序区分出正常剪接体与异常剪接事件,如下图2F,对野生转录本和突变转录本产物的凝胶电泳强度进行相对定量,超过50%的剪接异常比率被认为符合PS3条件。小于10%的比率被认为符合BS3。

3)CRISPR/Cas9与 iPSC-CMs RT-PCR实验:
虽然minigene实验可以较可靠的评估多数影响剪接的变异,但若异常剪接位于第一个或最后一个外显子,或者罕见剪接位点并非为标准的AG-GT位点剪接,Minigene可能很难获得较可靠的评估。
本研究中,KCNQ1基因 c.386+6T>G(第一个外显子)、SCN5A基因 c.393-5C>T (AC-GT splice site)及SCN5A基因c.4437+5G>A (AG-AT splice site)三个变异,无法通过minigene进行评估,本研究通过CRISPR-Cas9技术在正常人来源的iPSC中引入突变位点,之后分化为iPSC-来源的心肌细胞(iPSC-CMs),最终收集细胞进行RT-PCR,对比正常对照和阳性对照来评估剪接效应。
如下图所示,SCN5A c.4437+5G>A 变异导致产生一个Pseduo-Exon25,影响剪接过程。而KCNQ1 c.386+6T>G及SCN5A c.393-5C>T并未影响剪接,其中SCN5A c.393-5C>T之前已做过minigene实验被报道过,显示导致外显子跳跃,然而,因为非标准剪接位点的使用,导致实验不恰当的结论。与c.393-5相同位置的另一变异.393-5C>A在gnomAD数据库中有45个等位检出,显著高于2.5e-5频率阈值,进一步剪接支持c.393-5C>T变异可能为良性,与我们的RT-PCR结果一致。
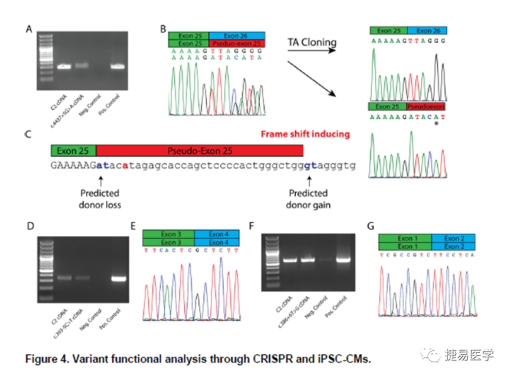
4实验结论
在本项研究中,我们通过minigene实验以及基于诱导多能干细胞的RT-PCR实验,实现了对13个意义未明变异的重新变异定级,其中有9个VUS变异调整为LP,1个VUS变异调整为LB等级,其中有3个LP变异调整为P。
随着NGS在临床的不断应用,VUS变异的解读难题也日渐凸显。近几年RNA水平的研究给VUS变异的解读带来新的思路,VUS变异在功能性证据支持下实现重新分类,有效提高了临床诊断率。但RNA研究或验证常会遇到相关样本难以获取问题,minigene以及诱导多能干细胞则无疑为优选,前者是剪接异常验证的有效利器,后者更为RNA水平研究、疾病机制研究甚至药物筛选提供最佳载体。