


腓骨肌萎缩症(peronial myoatrophy)又称Charcot-Marie-Tooth病(CMT),是一组最常见的家族性周围神经病,本病由Charcot,Marie和Tooth于1886年首先报道,故又称Charcot-Marie-Tooth(CMT)病。由于以腓骨肌萎缩为主要临床特征,故又称腓骨肌萎缩症(peroneal myoatrophy)。根据神经电生理、病例特点,CMT 可分为脱髓鞘型 (CMT1 型)、轴索型(CMT2 型)和中间型(ICMT 型)。CMT1A是最常见的CMT亚型,占所有CMT病例的40-50%,其次是CMT2,约占20%。由于在同一家族中出现的CMT1和CMT2临床表型的重叠,也发现了一些中间的CMT亚型。
腓骨肌萎缩症与许多基因的显性或隐性突变有关,已有90多个CMT疾病相关基因1000多个突变的报道。在过去的10年里,从细胞生物学和转基因啮齿动物模型中获得的进展,使得靶向分子治疗成为了 CMT 治疗新的研究方向。目前临床治疗该病主要采取对症支持疗法,尚无特殊疗法。因此,研究人员迫切需要一个更能概括这种疾病特征的模型用于该疾病的研究。对于神经退行性疾病,来自患者特异性诱导多功能干细胞(iPSCs)的神经元为疾病建模和临床前研究提供了宝贵的资源。近年来,利用iPSCs及其来源的各种神经元应用于神经系统疾病,如帕金森氏病、老年性痴呆症、脊髓侧索硬化症、脊髓肌肉萎缩症及舞蹈症等,为神经性退行性疾病的研究与治疗带来了希望。
CMT2具有明显的临床和遗传异质性,目前已经鉴定出50多个CMT2的致病基因,但仍有近60%CMT2患者未被遗传诊断。这使得CMT成为最具遗传多样性的遗传疾病之一,并对识别可用药靶点提出了独特的挑战。
在最新发表的研究中,研究人员利用诱导多能干细胞(iPSCs)分化为运动神经元和感觉神经元,以此为模型对CMT2的致病机制进行探索。在此基础上寻找到了针对该疾病的靶向药物(DLK抑制剂),该药物可以通过恢复线粒体功能障碍,逆转CMT2的部分表型,为CMT2治疗指明道路。该研究成果2021年 6月发表在Brain(IF=13.501)中。

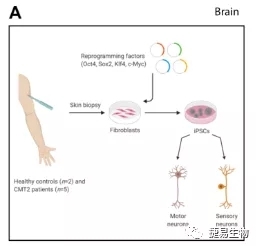
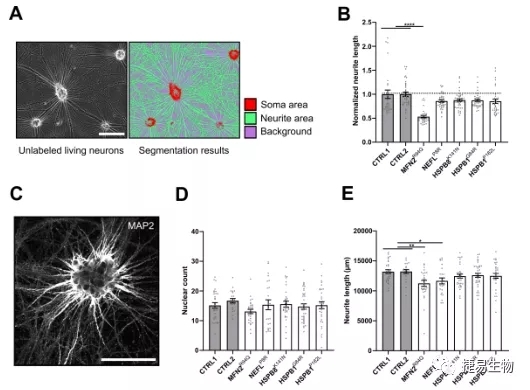
研究人员利用5个不同的CMT2突变患者和2个健康人的皮肤成纤维细胞在体外生成了iPSC系,同时利用CRISPR/Cas9基因编辑技术修复了CMT2(MFN2 R94Q)突变型,使其恢复正常。在后续的分化研究中,突变型、野生型和修复型iPSC同步分化为运动神经元 (MNs)。CMT2患者来源的运动神经元表现为神经突网络缺陷,其电生理特性也发生了改变。在以往的研究中,已经发现在iPSC来源的神经元模型和周围神经病变的动物模型中神经突网络的改变,对于CMT2患者来说,研究人员利用高通量自动荧光共聚焦显微镜测定后认为突变型(MFN2 R94Q和NEFL P8R)神经突长度显著减少,造成神经突网络的这些微小变化会导致神经元活动改变,主要是在微电极阵列(MEA)实验。在不同发育阶段,由CMT2患者的ipsc衍生的MNs自发电活动都会发生变化。
在以往对CMT疾病的研究中报道过,由ips衍生的神经元轴突会出现运输缺陷,主要表现为线粒体和溶酶体运动速率下降。在本研究中,5种基因型的CMT2患者iPSC衍生的神经元中,同样观察到了线粒体、溶酶体运动速率下降和线粒体形态的改变,这些证据都表明轴突运输发生受损。
由于CMT2患者在临床表型上存在异质性,这5名患者中基因型为MFN2 R94Q和NEFL P8R患者同时表现出运动和感觉症状障碍。因此在后续的研究中,研究人员将这两例患者来源ips分化为感觉神经元(SNs)。与运动神经元相似。这两个突变型在第38-50天时神经突长度显著减少,线粒体和溶酶体运输的速度明显高于健康对照组的细胞。
利用CRISPR/Cas9基因编辑技术修复的CMT2(MFN2 R94Q)型中,修复后的iPSC衍生的运动神经元 (MNs)和感觉神经元(SNs)的神经突长度得到了恢复。同时,细胞外电生理特性的紊乱也得到了纠正,这表明虽然CMT2存在多种致病基因和临床异质性,但在iPSC来源的运动神经元 (MNs)和感觉神经元(SNs)检测到的细胞特性能够反映CMT2的统一的特点。
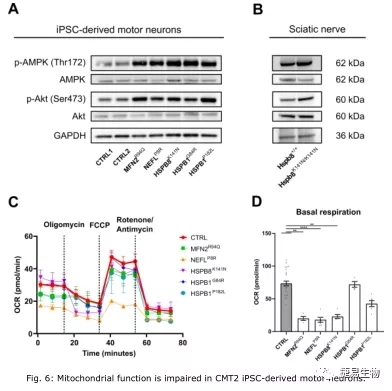
ipsc来源的CMT2运动神经元(MNs)线粒体改变
研究人员通过对第50天运动神经元(MNs)进行了大规模rna测序中,确定了所有CMT2基因突变型所共有的740个转录本的核心谱,并对这差异基因进行了GO分析。其中“呼吸链”功能发生了显著改变,这也表明在所有CMT2患者的iPSC系中,线粒体运输和形态都受到影响,同时PI3K-Akt信号通路也被显著富集,这说明Akt和AMPK等胞质应激整合子变化可能是由线粒体功能障碍造成的。由于AMPK是众所周知的细胞能量代谢传感器,研究人员提出这些CMT2突变是否会造成氧化磷酸化障碍,结果显示在5个不同的CMT2突变患者iPSC衍生的运动神经元中线粒体基础呼吸作用显著减少,并伴随着改变线粒体的形状,以及部分基因型出现mtDNA拷贝数的减少。
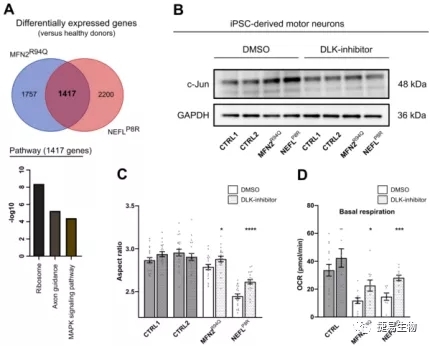
DLK抑制可改善CMT2A运动神经元的线粒体功能障碍
由于线粒体功能障碍是这5种CMT2衍生的运动神经元的共同特征,主要是影响线粒体功能障碍的应激通路被过度激活,因此研究人员提出是否可以通过调节这些应激通路改善该疾病的表型,DLK(也称为MAP3K12)抑制剂可以靶向这些应激诱导通路的转录,另外DLK作用于应激反应JNK通路(MAPK蛋白家族成员)的上游,目前正在进行肌萎缩性侧索硬化症(ALS)的I期临床试验中,因为它已被证明不仅能减少JNK的激活,而且还能延迟SOD1 G93A小鼠神经肌肉连接处的去神经保护。使用DLK抑制剂处理运动神经元(MNs)后, DLK抑制导致线粒体长径比和基础呼吸的增加。此外,还可以部分改善线粒体运输速度和线粒体移动百分比的轻微增加。这些结果表明,抑制DLK能够部分挽救线粒体功能障碍,显示了该抑制剂广泛的治疗潜力,通过靶向这些多种疾病所共有的通路可能为CMT2治疗指明道路。