


唐氏综合征(DS),是最常见的染色体遗传病,发病率为1/800~1/1000,是由21号染色体重复导致的遗传物质异常疾病。唐氏综合征患者主要特征为智能落后、特殊面容和生长发育迟缓,可表现为先天性心脏病、十二指肠狭窄、阿尔茨海默病、白血病、免疫缺陷病等。在我国大约有100万以上的DS患者,对于唐氏综合征,由于在目前缺乏有效的治疗手段,对患儿家属和社会产生了较大的精神和经济负担。
针对唐氏综合征(DS)研究中主要利用转基因小鼠模型和少量的人体脑组织标本,然而由于动物模型不能完全模拟人类的疾病,来源于人体的标本也非常有限等原因极大的限制了对唐氏综合征和人类其他三体疾病的研究。人类诱导多能干细胞(iPSCs)技术的问世为生命科学的研究和人类疾病的治疗都带来了巨大的希望,特别是为研究神经发育疾病提供了前所未有的机会。利用iPSC技术,在以往的研究中人们发现,DS患者来源的 iPSC分化后的神经元有明显的突触缺陷,神经元迁移和轴突投射受损,但其皮质发育受损的机制尚不清楚。
大脑类器官培养系统的最新进展为研究人类发育障碍开辟了新的途径。研究人员可以利用诱导多能干细胞从三维(3D)角度诱导出类脑组织和器官。由于类脑器官能部分模拟3D 大脑形成的发育过程,因此,它们不仅有助于对人脑发育进行建模,还可对与大脑发育相关的疾病进行研究。近年来,一些研究团队通过类脑器官模型,阐明了小头症、自闭症、Miller-Dieker综合征等神经发育障碍的发病机制。
在最新发表的研究中,研究人员利用诱导多能干细胞(iPSCs)分化的大脑类器官进行了组织学检测和单细胞RNA-Seq (scRNA-Seq)分析,以探索早期大脑发育中与DS相关的细胞类型异常。此外,使用CRISPR/Cas9、CRISPR干扰(CRISPRi)和小分子抑制剂治疗,逆转了神经形成缺陷,增加了DS-hiPSC分化的大脑类器官的大小。该研究成果发表在J Clin Invest (IF=11.8633)中。

内容如下:
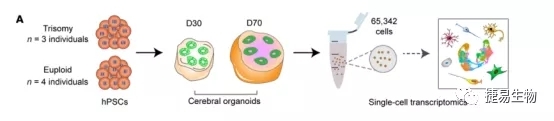
1. 单细胞RNA-Seq揭示了21三体类器官中神经发育的改变
本研究中选择3名DS患者和4名正常人的iPSC系,在形成类器官的过程中,DS-iPSC同样可以分化形成区域化和皮质层,为进一步的了解三体和整倍体类器官的细胞类型特异性转录组变化,研究人员绘制了2组大脑类器官在第30天和第70天共65342个单细胞图谱,其中鉴定到8种主要的细胞类型并根据已知细胞类型标记物的表达进行注释。
与整倍体类器官相比,DS大脑类器官的神经发育发生了明显改变。与整倍体类器官在第30天的发育状态相比,DS类器官从祖细胞到神经元的发育轨迹出现了延迟状态。GO分析结果显示,所有聚类间的差异表达基因(DEGs)富集在神经发生、前脑发育和神经前体细胞增殖等生物过程中,通路富集分析表明与神经发生相关通路都发生了明显改变。
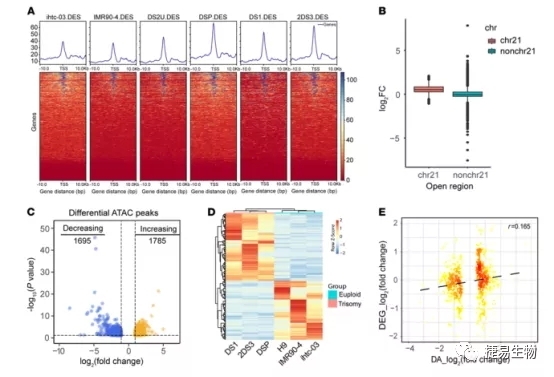
2. DS- iPSC大脑类器官染色质可及性受损是转录受损的原因
染色质的可及性是指染色质中的DNA能与转录因子等蛋白复合物结合的区域,对染色质可及性的测定可为获取开放区域的信息、核小体定位信息以及转录因子结合信息提供基础依据。目前多利用染色质转座酶可及性测序法(ATAC-seq)研究染色质的可及性,即某个时间点同时进行转录的 DNA区域。该技术仅利用少量细胞就可以识别基因组中所有调控序列,极大增加了人们对基因表达调控机制的理解。
ATAC-seq联合转录组测序分析主要研究染色质可及性与表达水平之间的关系, ATAC-seq检测到的丰度变化的DNA序列区域对应的转录表达量是否发生变化,以及找到对应的转录本相关基因的上游调控序列,从而对基因功能进行分析。
在本研究中DS类脑器官的染色质可及性分布总体无显著性变化,但令人惊奇的是DS的21号染色体中启动子区域的染色质可及性增加,同时其他染色质中也出现了可及性的显著变化,在DS类器官中发现共有3480个基因组区域内染色质开放性发生了变化。这其中,PAX6、GLPER、PTCH1、LMO1、VCAM1和WNT7A等与中枢神经发育相关基因启动子区染色质开放程度明显降低。许多受SOX2、lsl1和Rfx5转录因子调控的基因染色质可及性也发生了降低。通过对分化30天的类脑器官进行批量RNA-seq显示,与之前scRNA-Seq相似,差异表达基因(DEGs)都富集在神经系统发育、细胞增殖和神经发生的生物过程中,特别是与增殖相关的Ki67 和PAX6基因表达量显著降低。利用STRING 数据库绘制了参与神经形成相关的20个差异蛋白和细胞增殖相关的29个差异蛋白的蛋白互作网路图。GO分析同样显示这些上调和下调的基因富集在中枢神经系统神经元分化、神经元迁移和谷氨酸受体信号转导等生物学过程中。
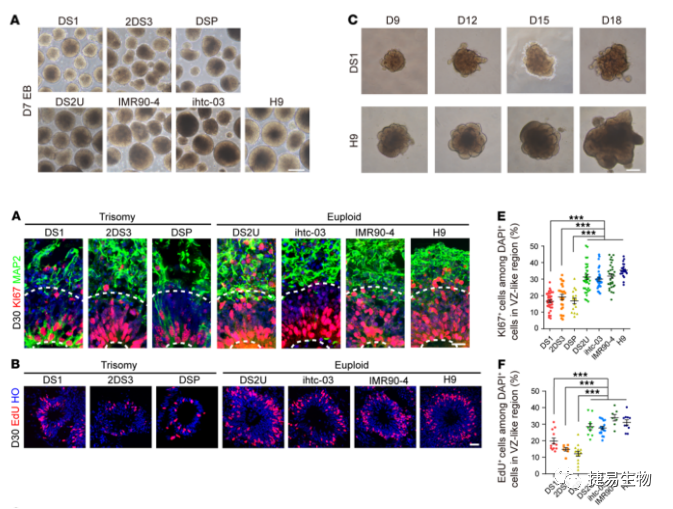
3. NPC增殖减少导致DS-hiPSC分化的皮质类器官变小
为了验证RNA-Seq中的结果,研究人员比较了DS和对照组的类器官中细胞的增殖情况,第7天时DS拟胚体(EBs)周长明显小于整倍体拟胚体(EBs),这与之前在DS患者中发现的脑体积减小的结果一致。在之前的报道中NPC的增殖缺陷可能会影响前脑的大小。因此本研究通过量化大脑类器官脑室区中Ki67 + /PAX6 +标记的细胞,发现不仅这些标记细胞的增殖受到影响,SOX2+标记的祖细胞数量也明显减少。
在对不同亚型的皮层神经元比较分析中,CTIP2+标记的细胞数量明显低于正常对照组。通过scRNA-Seq 和组织学分析显示,第70天的DS类器官中皮层成熟程度降低、成熟的上层神经元数量明显减少。此外,表达皮质上层神经元的标记基因BRN2和SATB2的细胞比例明显降低。另外组织学结果显示,在第70天,DS类脑器官中CTIP2+/SATB2+细胞的百分比显著降低。这些结果都说明了NPC增殖的缺陷可能与DS中神经形成的减少有关。

4. DSCAM-KD 可逆转DS类器官中细胞的增殖缺陷
先前的研究表明,DSCAM在DS个体和DS动物模型组织中显著过表达。本研究中同样发现了在DS类器官中DSCAM的mRNA和蛋白水平的表达增加,DSCAM所在的的开放染色质区域(OCRs)中染色质开放程度的显著增加。PAK1是DSCAM信号通路下游的调节因子,在神经发育阶段中细胞增殖和突触可塑性中起着关键作用。qPCR分析显示,在DS细胞中PAK1的 mRNA和蛋白表达水平高于整倍体对照细胞,同时磷酸化的PAK1同样表达水平升高。因此,研究人员提出假设:在体外观察到的DS的神经形成的缺陷可能与DSCAM及其下游蛋白PAK1表达的改变有关。
通过CRISPR/Cas9基因编辑手段在DS患者的iPSCs中构建了DSCAM敲除- iPSC系并分化为大脑类器官。单细胞RNA测序(scRNA-seq) 结果显示DSCAM-KD组中的基因表达模式更接近于整倍体类器官中的结果。主要表现为在DS组中平均表达水平下调基因在DSCAM-KD组中恢复到与整倍体组相似的水平。此外与DS1类器官相比,DSCAM-KD类器官的所有参数都有部分恢复。
进一步研究人员发现抑制DSCAM基因表达水平可以rescue NPC的增殖缺陷。这些结果表明,21三体类器官的增殖和神经形成缺陷可以通过调节DSCAM基因来修复。

考虑DSCAM/PAK1通路参与DS中神经发育过程,选择调节PAK1磷酸化的抑制剂FRAX486作为候选药物处理DS类脑器官和整倍体类器官。结果显示,FRAX486可以降低p-PAK1的蛋白水平,有效增加NPCs的增殖(第30天类器官中),并改善DS类器官神经形成缺陷。
总结
本研究中利用唐氏综合征(DS)患者iPSC衍生的类脑器官模型模拟了大脑中的皮质发育缺陷现象。DSCAM/PAK1信号通路的过度激活解释了唐氏综合征患者中神经元发育异常的部分原因。本研究中一方面为逆转DS患者神经发育异常和改善出生后认知功能提供了潜在治疗靶点,另外也为筛选治疗药物提供了新思路。