1背景介绍
在日常生活中,我们常听人自称不胜酒力,以为是谦虚,结果一杯下肚后竟然脸都红了,这种现象普遍发生在亚洲人群中,也被戏称为“亚洲红”。其实,亚洲红与人的基因息息相关,其原因是我们身上的ALDH2基因突变会导致乙醛脱氢酶等活性大大降低,造成酒精代谢物——乙醛的大量积累,从而引起过敏反应,出现面部发红。在世界范围内,约有8%的人群携带该基因上的一个SNP位点ALDH2*2(也被称为rs671),并且主要集中在东亚地区。ALDH2*2变异导致第504位氨基酸由谷氨酸变为赖氨酸,影响了底物与ALDH2催化活性位点的接触,即使是杂合携带者也会出现ALDH2酶活性的严重丧失,进而出现“亚洲红”。
携带“亚洲红”相关基因变异的人群不仅不胜酒力,在饮酒过度后还会增大其它疾病的患病风险,此前有研究提示,ALDH2*2变异与冠心病(coronary artery disease,CAD)的风险增加相关,其原因可能与内皮细胞(Endothelial cell, EC)功能障碍相关,但其中具体的机制尚不完全清楚。EC是血管壁的重要组成部分,通过调节血管张力和结构在维持心血管稳态中发挥重要作用,其功能障碍涉及多种人类心血管疾病,在冠心病发展中,EC功能障碍出现在早期,并可影响疾病的所有阶段,从起始到动脉粥样硬化性血栓并发症。
今年年初,斯坦福大学的吴庆明(Joseph C. Wu)教授团队在Science子刊 Science Translational Medicine(IF=19.319)上发表了题为:SGLT2 inhibitor ameliorates endothelial dysfunction associated with the common ALDH2 alcohol flushing variant的研究论文。借助iPSC模型,揭示了经ALDH2*2变异和饮酒共同作用诱发内皮细胞功能障碍的相关致病机制,通过体外iPSC药物筛选及体内小鼠验证,他们进一步发现,SGLT2抑制剂对ALDH2*2变异和饮酒共同作用诱发的内皮细胞功能障碍起到一定程度的治疗作用,并进一步探究了药物的作用机制。本文将简单介绍其内容及科研思路。
2提出假设
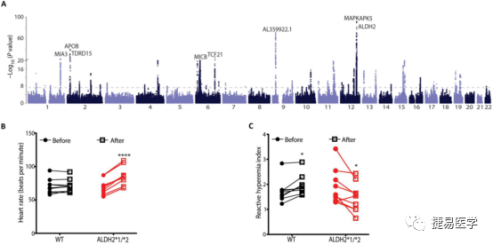
吴庆明团队通过大规模样本的GWAS研究,发现ALDH2*2是与冠心病强相关的几个SNP位点之一。随后他们使用了EndoPAT设备,分别检测了ALDH2*2变异携带者和正常人群饮酒前后的心率和反应性充血指数(reactive hyperemia index, RHI),发现ALDH2*2变异携带者饮酒后出现上述2个指标与正常人出现了统计学差异,提示EC功能障碍,与此同时logistic回归分析大规模样本数据库显示,ALDH2*2携带者长期饮酒导致的冠心病风险比正常人高约4倍。为此,他们提出假设:ALDH2*2与饮酒共同对EC功能障碍起促进作用,并诱发CAD。
3iPSC分化及相关表型
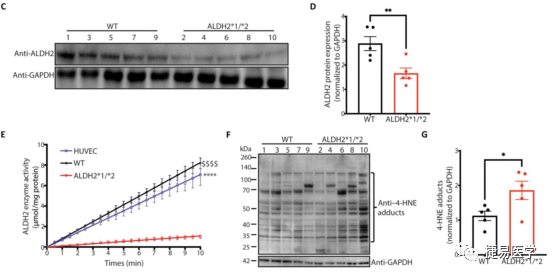
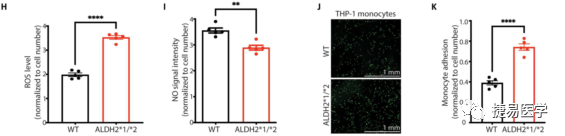
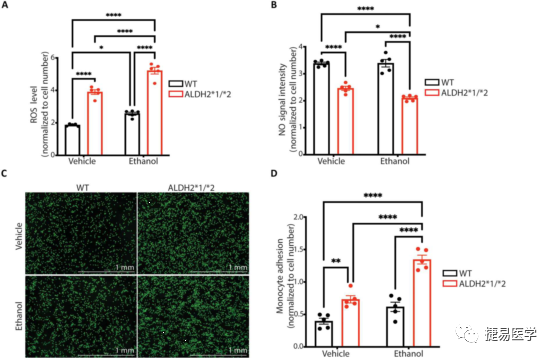
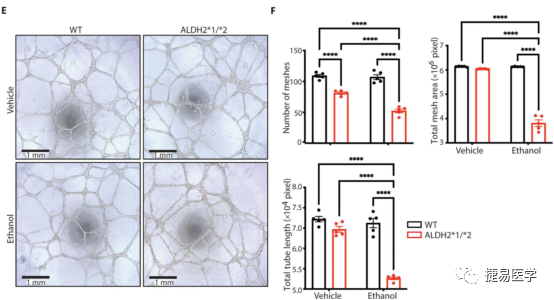
内皮细胞难以直接从人体分离并离体培养,因此经iPSC诱导分化的iPSC-EC是一个理想的体外研究模型,目前内皮细胞的分化技术已经成熟,且有文献报道了其与CAD相关的表型。吴庆明团队从ALDH2*2杂合携带者及正常人提取外周血诱导分化为iPSC-EC,检测了iPSC-EC的分化水平及ALDH2蛋白的表达量和活性后。探究了ALDH2*2变异株和对照组的iPSC-EC与EC功能障碍的相关表型,发现ALDH2*2组有着较高的4-HNE和ROS水平(与细胞毒性相关)及较低的NO生成水平(与血管功能障碍相关),此外,ALDH2*2组单核细胞黏附增加,提示内皮细胞炎症增加。另外,与对照组相比,ALDH2*2杂合变异株组形成管状网络的能力下降,上述表型提示了ALDH2*2变异与EC功能障碍的关联。
为了验证乙醇对ALDH2*2诱发CAD有协同作用。吴庆明团队又使用了一定浓度(5mM)乙醇处理ALDH2*2及对照组iPSC-EC细胞,并检测了ROS水平、NO水平、单核细胞黏附水平及形成管状网络水平,其结果证明,相对于对照组,乙醇加重了ALDH2*2变异诱导的EC功能障碍相关表型。
4通过CRISPR构建基因修复株修复表型
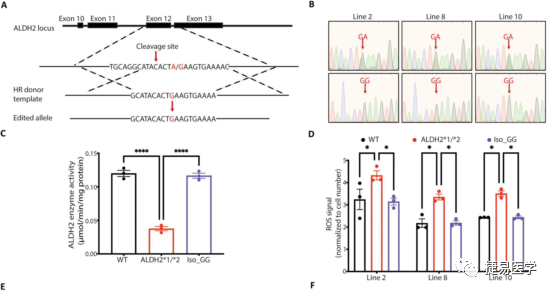
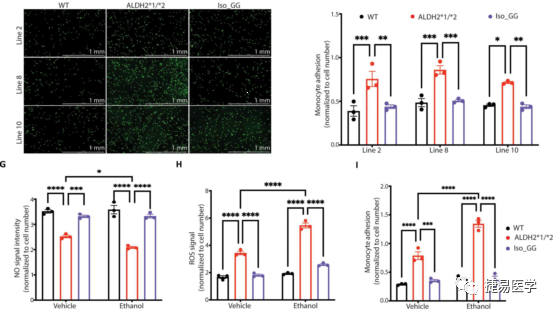
为了进一步验证上述表型和ALDH2*2的关联,吴庆明团队通过基因编辑技术CRISPR-Cas9构建了修复ALDH2*2变异位点的ALDH2*1/*2-corrected isogenic lines (Iso_GG)细胞系,对修复株的ALDH2活性进行检测后,发现其相较杂合突变株酶活性显著上升,与野生型接近。随后对ROS、NO、单核细胞黏附水平等指标进行了检测,发现修复株相较于变异株,EC功能障碍相关表型得到了显著的改善,且相关指标接近野生型。此外,修复株经乙醇处理后,上述表型相较用DMSO处理没有表现出现明显差异。进一步验证了ALDH2*2变异与表型的关联性。
5寻找机制
为了寻找潜在的机制,吴庆明团队首先对ALDH2*2杂合变异株和修复株诱导分化的iPSC-EC进行了RNA-seq,发现了1460个表达差异基因,根据与CAD表型的关联性,对这些基因进行筛选后,发现了14个与血管生成相关基因,21个与抗氧化剂或氧化剂相关基因,147个与炎症相关基因。针对这些关键的基因,吴庆明团队后续通过qPCR进一步验证了RNA表达上调/下降。经乙醇处理后,发现其中一些基因表达量有进一步上升/下降。此外,通过基因本体分析(Gene ontology analysis),发现多条信号通路有下调,其中AKT/eNOS通路尤其与表型密切。通过检测WB检测AKT和eNOS的蛋白表达水平和特定位点的磷酸化蛋白水平,发现ALDH2*2杂合变异株的AKT和eNOS磷酸化水平相较基因修复株显著降低。
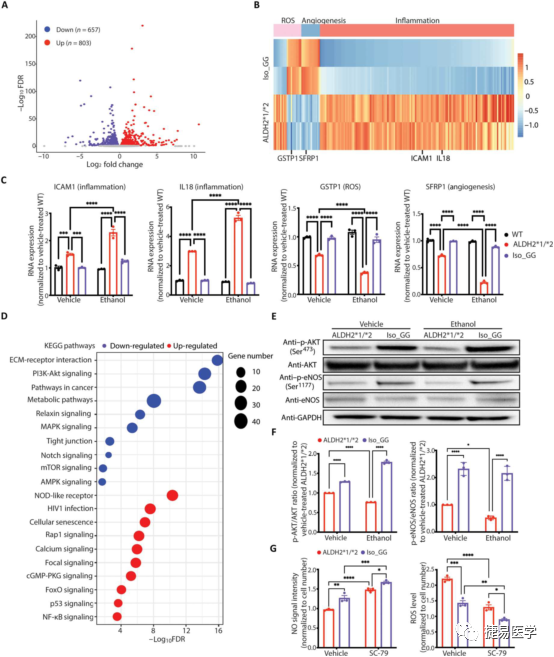
6通过iPSC-EC细胞进行药物筛选
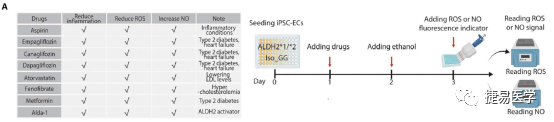
iPSC细胞为筛选具有人类特异性药物反应性的化合物提供了一个独特的平台,吴庆明团队以分化后的iPSC-EC细胞为模型,对8种以ROS,NO和炎症反应为主要作用靶点的药物进行了筛选,结果显示,恩格列净(empagliflozin)能在高浓度梯度下降低ROS,提升NO生成,对ALDH2*2杂合变异株iPSC-EC的EC功能障碍相关表型起到治疗作用。在体内,在小鼠模型中也得到了类似的结果。
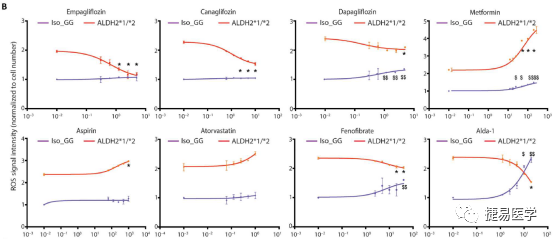
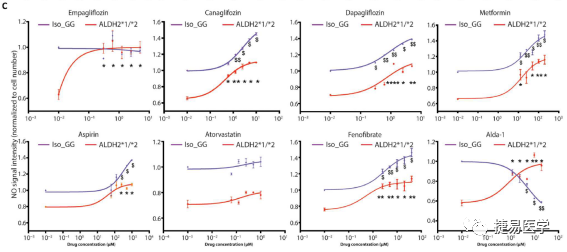
7寻找药物相关机制
恩格列净是一种钠葡萄糖共转运蛋白2抑制剂(were sodium-glucose cotransporter 2 Inhibitors,SGLT2i),但相关研究表明其主要作用靶点SGLT2不在心肌细胞中表达,吴庆明团队也在iPSC-EC细胞中没有检测到相应的SGLT2 mRNA表达,所以恩格列净可能是通过其它机制治疗由ALDH2*2变异和饮酒诱发的EC功能障碍。
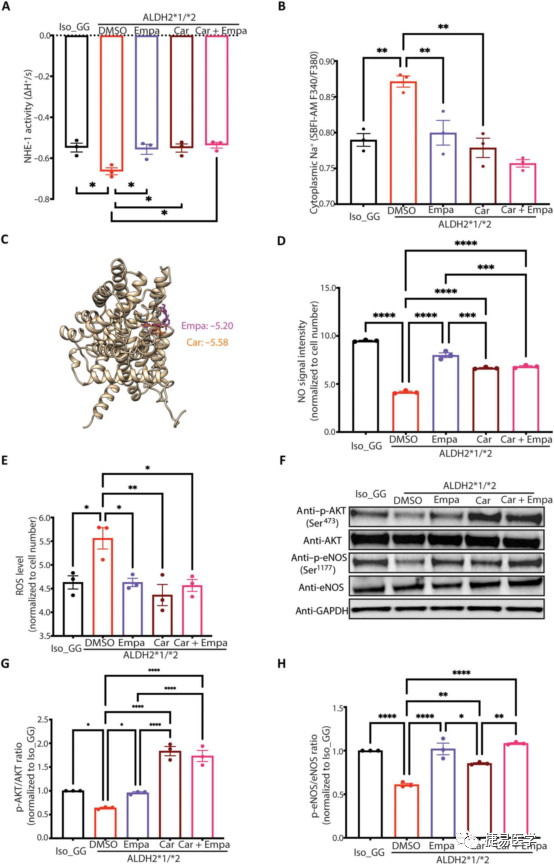
根据已有文献报道和mRNA检测,吴庆明团队发现NHE-1可能参与ALDH2*2变异相关的内皮功能障碍。对ALDH2*2变异株和修复株iPSC-EC的NHE-1活性和细胞质钠离子水平进行检测后,结果存在统计学差异,而ALDH2*2变异株在经过恩格列净处理后,其NHE-1活性和细胞质钠离子水平也与同DMSO处理出现了差异,提示恩格列净降低了NHE-1的活性。
为了探究ALDH2*2变异中,恩格列净是否直接作用于NHE-1,吴庆明团队使用了NHE-1抑制剂cariporide,在ALDH2*2 杂合变异iPSC-EC中,单独使用cariporide处理能降低NHE-1的活性,而同时使用cariporide和恩格列净处理没有进一步降低NHE-1的活性,提示恩格列净在iPSC-EC中直接作用于NHE-1。此外,相应生信软件分析NHE-1的结构后,也提示NHE-1能与恩格列净直接结合的可能性很大。接下来,吴庆明团队研究了恩格列净对基因修复株和ALDH2*2杂合突变株iPSC-EC在carporide处理下产生ROS和NO的影响。结果表明经cariporide处理后,ALDH2*2杂合突变株iPSC-ECs中NO的产生增加,ROS的产生减少,而加入恩格列净后没有进一步的变化,提示恩格列净是通过降低NHE-1活性对ROS和NO水平起到调控作用,进一步的,吴庆明团队也验证了恩格列净和cariporide对AKT/eNOS信号通路的影响,发现恩格列净和cariporide能激活AKT/eNOS信号通路,这些结果提示恩格列净通过NHE-1/AKT/eNOS通路缓解ALDH2*2诱导的氧化应激和NO减少。
8总结
庆明团队借助iPSC模型,研究了ALDH2*2变异与饮酒共同作用诱发内皮细胞功能障碍的潜在机制,除此之外,还通过药物筛选对潜在的治疗策略进行了探究:他们发现即使少量饮酒也会损害ALDH2*2等位基因携带者的内皮功能。恩格列净通过抑制NHE-1活性和激活AKT/eNOS信号通路,在体外和小鼠实验中缓解了这种功能障碍。考虑到内皮在血管功能中的重要作用,这些结果提示靶向ALDH2*2活性及其下游效应可能是控制ALDH2*2携带者血管疾病的有效策略。